Электрохимический процесс покрытия деталей в гальванической ванне, заполненной, например, разбавленным сульфатным электролитом. В качестве емкости подойдет стеклянная банка, электролит следующего состава: СrO3 – 150 г/л, H2SO4 – 1,5 г/л. Готовить на дистиллированной воде. Воду нагревать до 70 °С и в 2/3 объема растворяют СrO3. Затем доливают воду и перемешивают. Проводят анализ раствора на содержание в нем ионов SO4, в двуокиси хрома они присутствуют в виде примесей. После добавления необходимого количества H2SO4 электролит нужно проработать при t = 45-50 °С. Катодная плотность тока от 4 до 6 а/дм2. Время 4-6 часов – вполне достаточно для накопления в растворе ионов Сr. Электролит меняет цвет от темно-красного до темно-коричневого. Катод – стальная пластинка. Анод – из свинца. Затем идет процесс отстаивания. К пробному хромированию приступают через сутки. Электролит нагревают до 50 °С и выдерживают при этой температуре 3 часа. Затем завешивают пробную латунную деталь под током. Через час проверяют качество покрытия.
Кристаллики должны быть блестящими, а механические свойства таковы, что инструмент из режущей стали не оставляет следов. Если покрытие мягкое, то нужно провести дополнительную проработку в течение 2-х часов, с пробным хромированием. После хромирования детали подлежат обязательному кипячению в течение 1-1,5 часов в большом объеме воды. Затем 3 часа в сушильном шкафу при t = 130°С. Затем следует шлифование.
Аноды из сплава: Pb = 81-86%, Sn = 10-15%, Sb = 4% или чисто свинцовые. Во избежание окисления, аноды лучше опустить в подогретую воду и хранить до сборки приспособления. Если этого не было сделано, то с поверхности анодов нужно удалить корку, опустив их на 40 минут в электролит следующего состава: 100 г/л сегнетовой соли и 80 г/л NaON. Затем протереть тряпочкой.
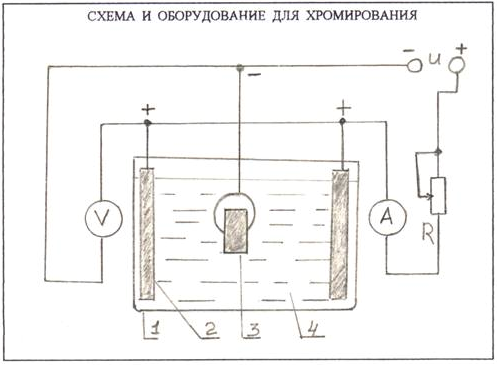
1 – стеклянная емкость (банка).
2 – анод (или аноды).
3 – хромируемая деталь (катод).
4 – раствор электролита.
